El investigador Gonzalo Jiménez-Osés del CIC BioGUNE.
Curar males hereditarios o crear vacunas 'a la carta': la nueva tecnología de IA que ya se aplica en España
Los sistemas de aprendizaje profundo que permiten predecir el plegado tridimensional de las proteínas abren la vía a nuevas y asequibles terapias.
29 enero, 2023 03:58Dictar los síntomas de una enfermedad a una inteligencia artificial para obtener un tratamiento adaptado y al momento suena a ciencia-ficción, pero estas herramientas existen y se aplican en España. La Fundación BBVA acaba de entregar su Premio Fronteras del Conocimiento 2023 en Biología y Biomedicina a tres pioneros de la aplicación de la I.A. a la biomedicina. David Baker, Demis Hassabis y John Jumper han dedicado décadas a desarrollar dos herramientas, AlphaFold2 y RoseTTAFold, que permiten conocer y anticipar el pliegue de las proteínas, una función clave tanto para el desarrollo como el tratamiento de múltiples enfermedades.
"El programa AlphaFold2 es el más conocido estos días en cuanto al uso de la inteligencia artificial para la predicción de la estructura tridimensional de la forma de las proteínas", explica Gonzalo Jiménez-Osés, biólogo computacional e investigador principal del CIC BioGUNE de Bilbao. Su equipo ha trabajado en paralelo con el de Baker en la Universidad de Washington, donde nació la herramienta RoseTTAFold: si la primera desentraña el comportamiento de proteínas existentes, la segunda puede crearlas a la carta. Su nombre, derivado de la egiptología, se refiere código que permitió desentrañar los jeroglíficos herméticos hasta entonces.
"Esto es lo que a mí me parece más importante: el poder crear estructuras proteicas que no existen la naturaleza porque no ha habido la presión evolutiva para ello, con unas propiedades que puedan hacer básicamente lo que queramos", prosigue Jiménez-Osés. El investigador lo define como el "cierre del paradigma", que permite explicitar el funcionamiento de las proteínas existentes y planear de forma tridimensional las futuras. "Podemos predecir cómo va a localizarse en un tejido determinado para interacturar con una dinámica terapéutica, o cómo crear un nuevo material para interrumpir la infección del virus de la gripe".
¿Por qué es tan difícil determinar cómo se van a plegar las proteínas con los medios tradicionales, incluso cuando conocemos su genoma y el orden de los aminoácidos que la forman? "Los factores que gobiernan ese plegamiento se escapan de las tres dimensiones del espacio", explica el biólogo computacional. "Si le asignásemos un número N, ese número sería muy, muy alto". La inteligencia artificial puede en cambio probar combinaciones, como un "niño que aprende a andar", y acabar ofreciendo resultados predictivos de alta fiabilidad.
Más importante todavía: todo lo aprendido se conserva en una inmensa base de datos que cooperará con futuras investigaciones y aumentará su precisión. "Miles de investigadores han proporcionado secuencias genéticas de todas las proteínas de todos los microorganismos y estructuras tridimensionales de muy alta calidad experimental. Los algoritmos inteligentes aprenden de ellos de tal manera que en cuestión de minutos se puede obtener una calidad de estructura tan buena como en un experimental pero con un coste y un tiempo mucho más asequible".

El laboratorio de Química Computacional del CIC BioGUNE. CIC BioGUNE
Tan asequible que, si bien los cálculos con millones de proteínas todavía requieren de superordenadores, las herramientas se pueden usar en un ordenador portátil "sin demasiado problema". Tampoco hace falta más infraestructura que las tarjetas gráficas que aceleran videojuegos, ni conocimientos de programación más allá del lenguaje básico Python. "Y la guinda: todo está en Internet", celebra González-Osés. "Puedes ir a una página web, teclear la secuencia de aminoácidos, y bajarte en minutos la estructura de una proteína prácticamente perfecta. Era impensable hace unos años".
Nuevas aplicaciones médicas
Durante su estancia en la Universidad de California en Los Ángeles -donde colaboró con Frances Arnold, una de las ganadoras de Nobel de Química de 2018-, González-Osés también tuvo línea directa con el equipo de Baker. "Yo soy químico de profesión, y siempre me fascinó la posibilidad de diseñar enzimas con una función biológica no natural, biocatalizadores que desbloqueen su capacidad intrínseca durmiente". Mediante esta intervención, se podría "reentrenar" el organismo de un paciente que esté sufriendo una enfermedad a causa de una mutación que interfiera en el plegado de las proteínas de su cuerpo.
Es el caso de la ataxia de Friedreich, una enfermedad hereditaria que aborda el laboratorio de Biología Computacional del CIC BioGUNE. Otra línea es el desarrollo de biosensores para tests de orina que detecten enfermedades para los que no hay aún marcador. Pero es solo el principio: el grupo de Jumper trabaja en una vacuna contra la malaria y el de Baker logró diseñar con estas herramientas una vacuna contra la Covid en uso en Corea del Sur y anticuerpos neutralizantes contra el virus de la gripe. "El anticuerpo no deja de ser una proteína", recuerda el investigador.
¿Y qué hay del alzhéimer, la enfermedad más famosa producida por una alteración en el pliegue de las proteínas tau y beta-amiloide? Es uno de los campos más complicados, explica, por los acúmulos de proteína mal plegada y la tendencia a agregarse en el cerebro que se produce a medida que progresa. "Si introduces en AlphaFold2 la secuencia de la proteína, no te van a dar la estructura que después se va a agregar. Te va a dar la forma estable que tienes tú en el organismo". Predecir la formación de esas "estructuras desordenadas" es uno de los retos que tiene la inteligencia artificial por delante.
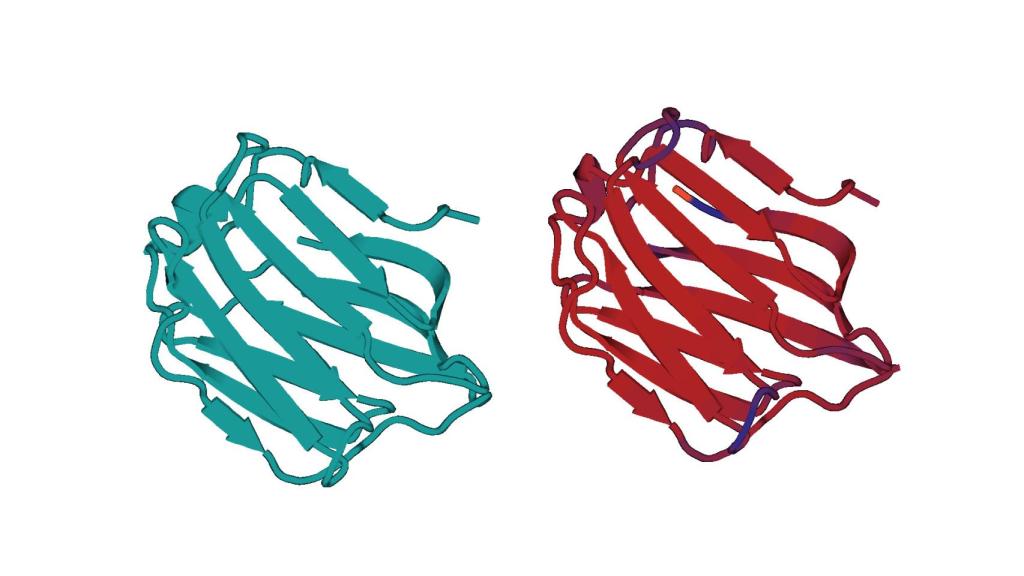
Estructura tridimensional de la proteina Galectina-4 mediante rayos X (Drcha) y predicción computacional (Izqda). CICbioGUNE
España está "relativamente bien posicionada" en esta carrera tecnológica por la nueva medicina, valora Jiménez-Osés, destacando el supercomputador MareNostrum de Barcelona. La precariedad, sin embargo, sobrevuela estos proyectos como tantos otros. "España adolece de muchas carencias, no es tan fácil mantener una carrera investigadora, que los jóvenes que se han formado fuera puedan volver o montar un grupo de investigación. Tampoco es cuestión de dinero sino de mentalidad: intentar que los investigadores tengan ciertas facilidades y cierta financiación, y tener una red sólida que permita pasar de las palabras a los hechos", concluye.