Dsuvia, el nuevo fármaco para el dolor.
Así es el fármaco contra el dolor 1.000 veces más potente que la morfina
- La FDA aprueba Dsuvia en medio de la polémica por el abuso de opioides en EEUU.
- Muere un bebé estrangulado en la siesta por un collar contra el dolor de dientes
- La chica que sufrió tres años de dolor crónico por hacerse este tatuaje con las defensas bajas
Noticias relacionadas
Desde hace varios años, el uso y sobreuso de analgésicos opioides (derivados de la morfina) es un problema en todo el mundo. Sobre todo en Estados Unidos, donde se sabe que existen casos de falsificación de recetas médicas para poder adquirir estos productos, difíciles de conseguir por su potencial adictivo.
Entre 1999 y 2016, solo en EEUU, más de 630.000 individuos murieron por sobredosis de drogas, y más de la mitad se debían al uso de opioides, según los Centros para el Control de Enfermedades (CDC). De forma específica, el fentanilo, un analgésico y anestésico derivado de los opioides ha destacado por ser uno de los protagonistas de tales sobredosis desde 2013.
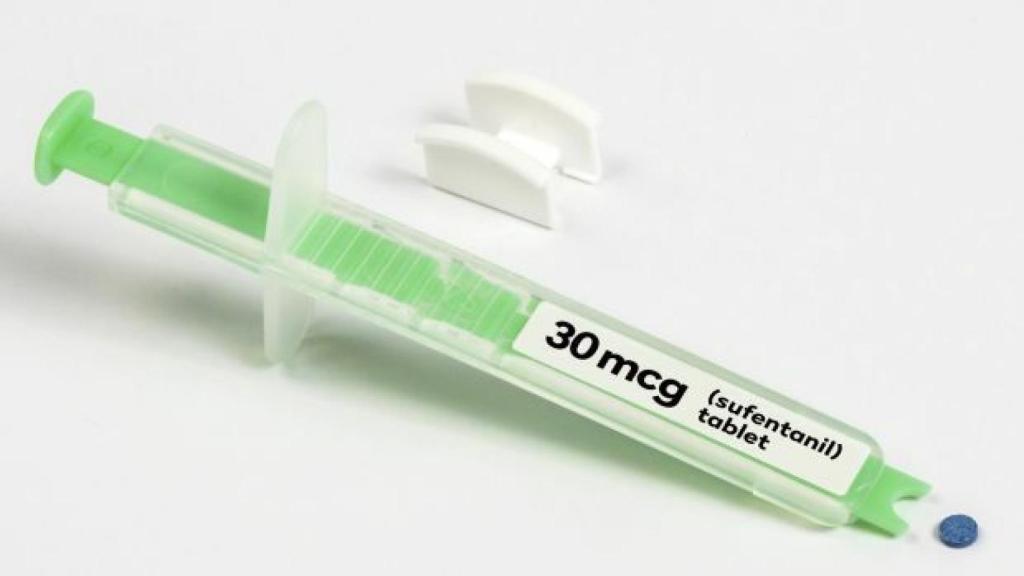
Sin embargo, y a pesar de que tal crisis continúa, la Food and Drug Administration (FDA), el organismo que regula fármacos y alimentos en EEUU, ha aprobado recientemente un nuevo fármaco opioide que asegura ser hasta 1.000 veces más potente que la morfina: Dsuvia, una nueva forma del sufentanilo, una versión que multiplica por 10 el potencial del fentanilo.
Por qué se fabrican nuevos opioides
Según la FDA, el objetivo de aprobar este fármaco es la necesidad de su uso para aliviar el dolor de los soldados en batallas. Pero, sin embargo, los expertos aseguran que es totalmente innecesario fabricar una sustancia así teniendo en cuenta el contexto actual. El fentanilo como tal, a pequeñas dosis, ya ha demostrado poder causar casos de sobredosis. Por tanto, el sufentanilo, diez veces más potente, puede causar estragos.
Y ahí entra en escena Dsuvia, una versión del sufentanilo en forma de comprimido de 30 microgramos (el sufentanilo anteriormente tan solo se encontraba en forma de inyectable). Dsuvia, de la misma forma que otros fármacos actuales como el Abstral (fentanilo), se toma en forma de comprimido sublingual a través de un aplicador especial que se administra en dosis única. El pasado 12 de octubre, el comité asesor de productos farmacéuticos analgésicos y anestésicos de la FDA votó a favor de este fármaco fabricado por AcelRX Pharmaceuticals. Y, desde el pasado 2 de noviembre, esta aceptado para su uso. Pero no estará disponible para ser comercializado hasta principios de 2019.
Un fármaco de uso restringido
Según Scott Gottlieb, comisionado de la FDA, a pesar de la aprobación de Dsuvia, se sabe que existen preocupaciones sobre su potencial abuso. Por ello, Dsuvia no estará disponible en farmacias minoristas y su uso quedará restringido a entornos supervisados médicamente (como los hospitales). Así mismo, Gottlieb también apunta al uso del aplicador especial para que tan solo se puedan consumir dosis únicas, algo que a su vez podría usarse como preventivo de una sobredosis accidental.
Por su parte, el comisionado ha insistido en el principal uso de Dsuvia, que no sería otro que la aplicación militar, haciéndolo fácil y rápido de usar en situaciones de batalla donde los fármacos inyectables no suelen ser una opción viable. De hecho, incluso el Departamento de Defensa de los Estados Unidos ha mostrado gran interés por adquirirlo.
Sin embargo, los críticos no escasean, como es el caso de Andrew Kolodny, jefe de la Opioid Policy Research Collaborative, en la Universidad de Brandeis. Según Kolodny, los soldados ya tienen fármacos contra el dolor de administración sublingual, por lo que Dsuvia es un producto innecesario y llega a tildar su fabricación de "ridícula".
Además, tampoco se acaban de vislumbrar claramente las medidas de seguridad contra los posibles abusos y sobredosis, dada la incapacidad de la FDA para imponer controles, según los mismos críticos.
Por su parte, Gottlieb reconoce que la FDA debe considerar más si cabe los potenciales riesgos del uso y aprobación de fármacos de este tipo, pero a su vez recuerda que el Congreso de los Estados Unidos ha otorgado a la FDA la potestad de realizar encuestas posteriores a la puesta en venta de determinados productos, con el objetivo de rastrear posibles abusos de los mismos y retirarlos si fuese necesario. De hecho, existe un caso reciente, como el de Opana ER, el cual se retiró a principios del año 2018.
Aún así, los críticos aseguran que durante los primeros meses de puesta en venta de Dsuvia, se esperan casos de abuso y muerte secundaria al mismo, a pesar de todas las advertencias previas.