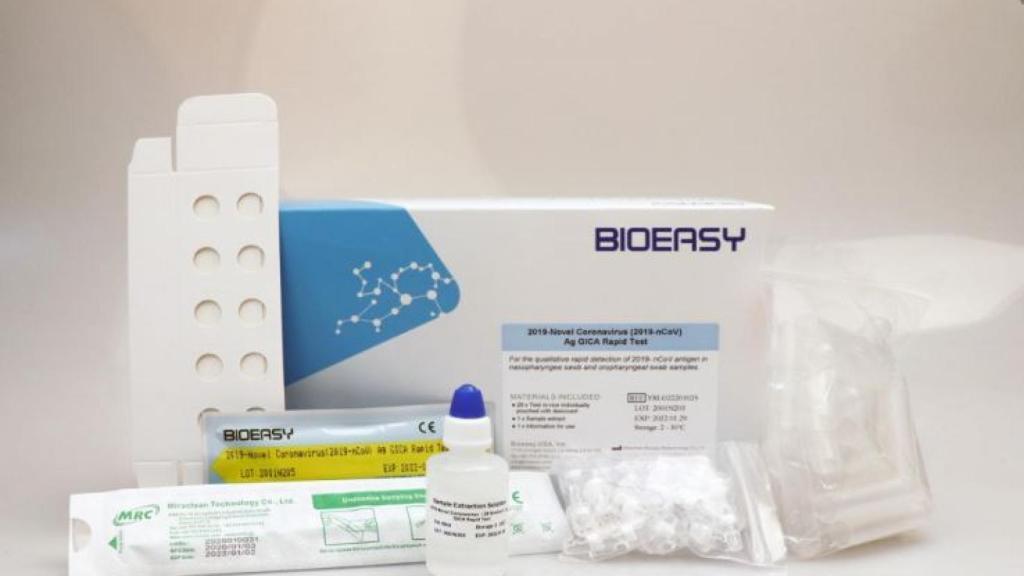
Los test rápidos adquiridos por Sanidad. Bioeasy
El Gobierno se escuda en la UE para defender la compra de los test fallidos que China no homologa
Fernando Simón reconoce que una partida de 9.000 test salió defectuosa, pero señala que las prueban tenían el marcado CE, la homologación europea.
26 marzo, 2020 14:02Noticias relacionadas
Jamás una buena noticia se había convertido tan rápido en una mala. La compra por parte del Gobierno español de alrededor de más de un millón y medio de test para detectar el coronavirus Sars CoV-2 ha empezado con muy mal pie, ya que la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC) ha explicado en un documento que las primeras pruebas disponibles de este tipo en España han mostrado en las validaciones que se llevan a cabo en el Centro Nacional de Epidemiología del Instituto de Salud Carlos III y en algunos hospitales una sensibilidad inferior al 30%, por lo que no merece la pena introducirlos en la práctica clínica.
Antes estas noticias, el director del Centro de Alertas y Emergencias sanitarias, Fernando Simón, ha explicado que el problema sólo afecta a un lote de 9.000 test adquiridos, que venía defectuoso y del que ya se ha pedido una sustitución a la empresa fabricante, en este caso Bioeasy Biotechnology. "Tenemos más proveedores", ha explicado el experto, sin identificar cuántos y cuáles.
Pero por si esto fuera poco, la puntilla la ha dado la cuenta de Twitter de la embajada de China en España, que señalaba a media mañana que Shenzhen Bioeasy Biotechnology no ha conseguido todavía la licencia oficial de la Administración Nacional de Productos Médicos de China para vender sus productos.
3⃣ Shenzhen Bioeasy Biotechnology no ha conseguido todavía la licencia oficial de la Administración Nacional de Productos Médicos de #China para vender sus productos.
— Embajada de China en España (@ChinaEmbEsp) March 26, 2020
Sin embargo, Fernando Simón ha dejado claro que estos 8.000 test adquiridos sí tenían homologación europea o, lo que es lo mismo, marcado CE. De hecho, si uno se fija en la fotografía del producto, sacada de su página web, se puede ver las siglas que lo certifican.
"Bioeasy Biotechnology comenzó a producir el kit de prueba de coronavirus COVID-19 a partir de enero de 2020 gracias a su sólido equipo de I + D. Bioeasy es la primera compañía en el mundo en recibir el certificado CE para el kit de prueba rápida de coronavirus COVID-19. Estas pruebas de coronavirus se usan a nivel estatal en muchos países del mundo", reza también la web de la compañia.
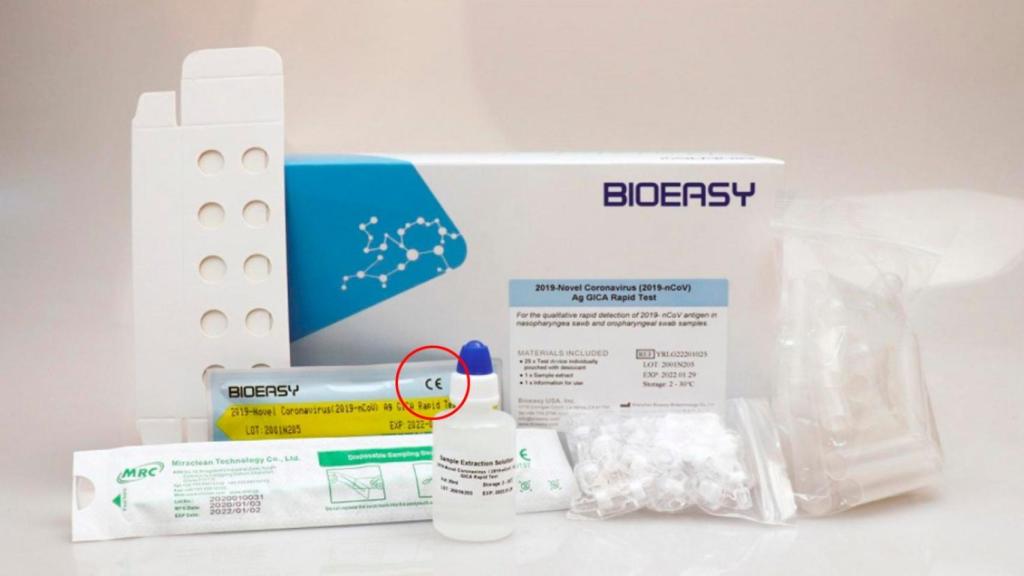
El producto con el marcado CE visible.
Según explicó a EL ESPAÑOL un proveedor de servicios sanitarios que prefiere no ser identificado, hasta ahora los productos sanitarios comercializados y utilizados en la Unión Europea, tenían que tener obligatoriamente este marcado. Sin embargo, la crisis del COVID-19 ha obligado a rebajar un poco las normas y ahora se pueden adquirir excepcionalmente productos con la homologación china y la estadounidense.
En la web de la Unión Europea se lee que "para poder venderse en la UE, muchos productos deben llevar obligatoriamente el marcado CE, que demuestra que el fabricante ha evaluado el producto y se considera que este cumple los requisitos de seguridad, sanidad y protección del medio ambiente exigidos por la UE. El marcado CE es obligatorio para los productos fabricados en cualquier lugar del mundo que vayan a comercializarse en la UE".
Así, España podría perfectamente haber comprado test sin homologación china, pero sí europea, aunque esto parecería indicar que estas primeras pruebas no han sido adquiridas en el país asiático, sino en otros, un extremo que Fernando Simón ni el Ministerio de Sanidad han aclarado.
A pesar de este contratiempo, la SEIMC alara que existen otros formatos ya adquiridos en España que requieren de otro tipo de lectura -fluorescente- que "están pendientes de ser evaluados".
También apuntan a la próxima introducción en territorio nacional de pruebas de detección de anticuerpos IgM e IgG en sangre que, aunque no están avaladas por muchas publicaciones científicas, avalan su uso tanto la OMS como la FDA, el organismo que regula fármacos y medicamentos en EEUU.





