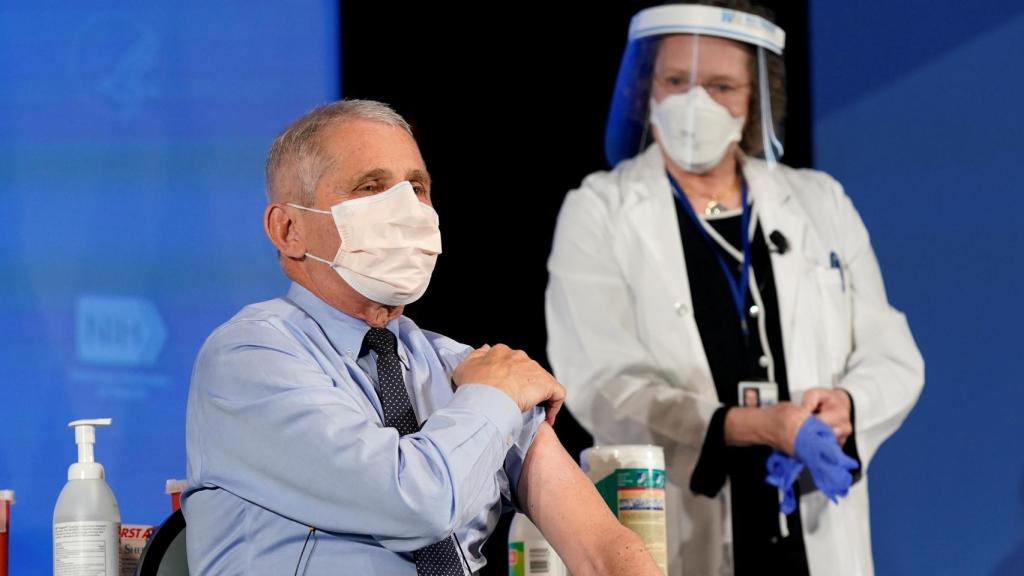
Anthony Fauci recibe la vacuna de Moderna. Reuters
Estas son las diferencias entre la vacunación de la Covid-19 en Europa y EEUU
Este domingo las cifras empezarán a equilibrarse, aunque Europa tardará en ponerse al nivel de EEUU en cuanto a número de dosis inyectadas.
27 diciembre, 2020 02:06Noticias relacionadas
Más de un millón de personas de EEUU han recibido ya la primera dosis de una de las dos vacunas para la Covid-19 aprobadas en dicho país: la de Pfizer BioNTech y la de Moderna.
Este domingo las cifras empezarán a equilibrarse, aunque Europa tardará -si lo hace- en ponerse al nivel de EEUU en cuanto a número de dosis inyectadas. Sin embargo, hay algo en lo que el Viejo Continente saca ventaja al todopoderoso gigante americano: la aprobación de la única vacuna autorizada en la Unión Europea es más garantista y completa que la que han obtenido las dos inmunizaciones en EEUU.
Mientras en EEUU ninguna de las dos vacunas han sido aprobadas ni autorizadas por la Administración de Drogas y Alimentos de los EEUU (FDA), en Europa la de Pfizer-BioNTech sí ha recibido una autorización de comercialización condicional para la inmunización activa para prevenir la Covid-19 causada por el virus SARS-CoV-2, en personas de 16 años o más.
Entonces, ¿por qué se han administrado un millón de dosis en EEUU? Lo que la FDA ha concedido a los dos productos es la Autorización de uso de emergencia (EUA), algo diferente a lo que se ha aprobado en Europa.
"La diferencia entre ese uso de emergencia y la autorización condicional, reside en que las empresas fabricantes tienen que cumplir con el plan de gestión de riesgo, obligaciónes de fármacovigilancia y el resto de responsabilidad legales", explicaban recientemente fuentes del Ministerio de Sanidad.
La de Europa es una autorización condicional porque se revisa al año y está condicionada a la presentación de otros resultados. Siempre el balance beneficio riesgo es favorable y la alternativa no compensa, hay más protección en términos de salud pública autorizándola que no, señalaban desde el mismo organismo.
Desde Pfizer, comentan a EL ESPAÑOL que "continuará realizando la vigilancia de seguridad de la vacuna Covid-19 como lo harían con cualquier medicamento o vacuna en el mercado".
El Comité de Medicamentos de Uso Humano (CHMP, por sus siglas en inglés) de la EMA, formado por expertos de las autoridades competentes de los diferentes Estados Miembros de la UE, entre ellos la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), completó la evaluación científica de la vacuna de Pfizer - BioNTech concluyendo por consenso que dispone de datos suficientemente sólidos sobre la calidad, seguridad y eficacia de la vacuna para recomendar una autorización de comercialización condicional.
De esta manera, se allanó el camino para que la Comisión Europea otorgara esta autorización y se convirtiera así en la primera vacuna frente a la Covid-19 que consigue el visto bueno de los reguladores europeos. Desde que esta autorización se produjo el pasado miércoles, este medicamento puede distribuirse en todos los Estados miembros de la UE.
La autorización de comercialización condicional es un instrumento contemplado en la legislación europea que permite una autorización ante una necesidad médica no cubierta, en la medida en que el beneficio para la salud pública de su inmediata disponibilidad es superior a la incertidumbre derivada de la limitación de los datos disponibles.
Este tipo de autorización no es específica para esta situación; se ha concedido fuera y dentro de la pandemia y requiere de más datos que una autorización para situaciones de emergencia como la que se concede en otras regiones regulatorias.
Así, la luz verde europea es más segura que la que han otorgado no sólo EEUU, sino Reino Unido, el primer país en el continente europeo que empezó a vacunar.
Mientras que el reino de Isabel II empezó a hacerlo el 8 de diciembre, la Europa que sí se mantiene unida comienza 19 días después. Todo parece indicar que la espera habrá merecido la pena.