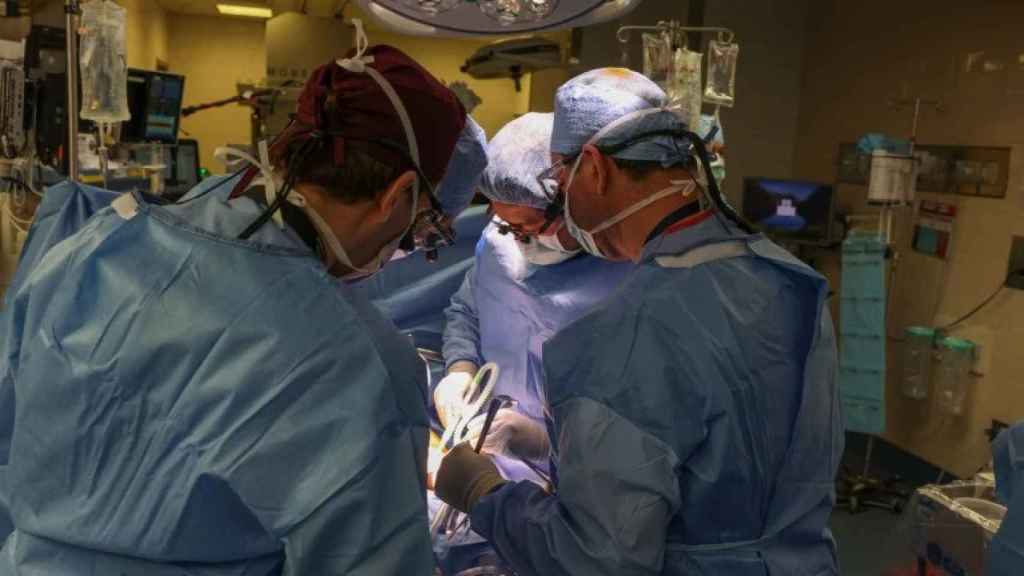
Imagen de un momento de la operación para trasplantar el primer riñón de cerdo a un receptor vivo. Massachusetts General Hospital
Por qué fallan los órganos de cerdo: dos estudios analizan el fracaso de los primeros xenotrasplantes
El análisis pormenorizado del tejido de los primeros corazones y riñones de cerdo trasplantados revelan reacciones a nivel inmunológico e inflamatorio.
23 mayo, 2024 02:30La carrera por los xenotrasplantes se ha acelerado enormemente en los últimos años. Sin embargo, las 'pruebas de concepto' han sido un fracaso: ninguno de los pacientes ha vivido más de dos meses.
Un par de estudios profundizan en las razones de por qué no lo han hecho y avisan de que serían muy distintas a los rechazos que se producen en el trasplante de órganos humanos.
Ambos proceden del equipo que realizó los primeros xenotrasplantes, el del Langone Health de la Universidad de Nueva York.
Ellos fueron los responsables de trasplantar, por primera vez, riñones y corazones de cerdo en individuos en muerte cerebral en el que se mantenían artificialmente las funciones corporales.
Lo hicieron en 2021 y 2022 y midieron minuciosamente la actividad del órgano y del receptor antes, durante y después del trasplante.
[Polémica tras la muerte del primer hombre con un riñón de cerdo: "En España no se habría permitido"]
El primero de los estudios ha sido publicado en Nature Medicine y analiza concienzudamente dos trasplantes de corazones de cerdo.
Mientras un equipo de cirujanos realizaba la intervención, otro paralelo tomaba muestras cada seis horas y observaba cambios en la transcripción de los genes, en las proteínas resultantes y en los metabolitos presentes en las células.
Así, en uno de los receptores, los investigadores observaron un incremento crítico de dos tipos de células del sistema inmune (linfocitos T y natural killer): de un 1% a las 30 horas del trasplante hasta un 20% tras 66 horas.
Esta reacción inmune se asoció a una complicación conocida como disfunción perioperatoria del xenoinjerto cardíaco, acompañada de inflamación causada por los intentos de curación del sistema inmune, que podrían haber espesado el tejido del órgano y obstaculizado su función.
El equipo investigador sospecha que una posible explicación a esta reacción pueda deberse en parte a que el corazón trasplantado era más pequeño de lo que debería ser por el tamaño del receptor, lo que requeriría un procedimiento extra para compensarlo.
[La edad dorada de los trasplantes de órganos: "Hemos hecho rutinario algo de ciencia ficción"]
Esto podría haber cortado el flujo sanguíneo y el suministro de oxígeno al corazón, causando una lesión por isquemia-reperfusión, cuando la restauración del flujo sanguíneo se puede acompañar de la liberación de radicales libres de oxígeno, alteraciones en el metabolismo celular, etc. Condicionando un daño funcional y estructural.
Al contrario que en este caso, el curso del segundo trasplante —en una mujer; el primero fue en un hombre— fue bastante más suave, con "cambios relativamente menores en los perfiles de ARN, proteínas, lípidos y metabolismo" en comparación con el otro receptor.
Un rechazo sibilino
El segundo de los estudios, publicado por el mismo equipo investigador (procedentes de la Escuela de Medicina Grossman de la Universidad de Nueva York y del Broad Institute del MIT y Harvard) en la revista Med, da cuenta de los datos obtenidos en los xenotrasplantes de riñón de cerdo en receptores considerados legalmente muertos.
Comparando los tejidos de los riñones trasplantados con muestras de órganos que no habían sido objeto de trasplante observaron que, si bien los órganos no habían sido rechazados directamente, sí causaron una fuerte reacción en células mononucleares de sangre periférica, componentes críticos del sistema inmune.
También vieron un repunte en los mecanismos de reparación de tejidos en los riñones de cerdo, un proceso que tiene similitudes con la transformación de células sanas en cancerígenas.
[El doctor que ha logrado que una mujer dé a luz con el útero de su madre: "Es como ir a la Luna"]
Jeff Boeke, director del Instituto de Genética de Sistemas de la Escuela de Medicina Grossman y coautor senior de ambos estudios, considera que "estos resultados nos dan nuevas ideas de cómo podemos diseñar órganos de cerdo para trasplante, o personalizar los tratamientos inmunosupresores para mejorar la tolerancia a un órgano extraño".
Rafael Matesanz, fundador y exdirector de la Organización Nacional de Trasplantes, considera que, si bien estos trabajos no se refieren a los casos de pacientes trasplantados con órganos de cerdo, sí pueden dar pistas de por qué estos trasplantes fallaron menos de dos meses después del injerto.
"Sin duda, son estudios importantes que nos permiten saber qué es lo que está ocurriendo", explica a EL ESPAÑOL. "Saber qué modificaciones genéticas son necesarias y aquilatar el tratamiento inmunosupresor que se le da, porque este es más intenso que el que se le da a un receptor de un órgano humano".
[¿Y si funcionaran los trasplantes de órganos de cerdo?]
En 2022 se trasplantó el primer órgano de cerdo a un ser humano vivo. Se trataba de un corazón y su portador vivió 60 días con él. En 2023, otra persona recibió otro corazón, muriendo a los 40 días.
El pasado marzo, un hombre fue trasplantado con un riñón de cerdo. Al igual que los anteriores pacientes, vivió menos de dos meses. Hay un cuarto receptor vivo de un xenotrasplante: una mujer que recibió un riñón de cerdo a finales del pasado abril y que, hoy por hoy, está estable en el hospital.
Los estudios pormenorizados de los casos en pacientes legalmente muertos dan cuenta de las reacciones inmunes que tenían lugar a pesar de que parecía haberse evitado ese rechazo inmediato.
[Macchiarini, el doctor del horror: de revolucionar la cirugía en Barcelona a matar a sus pacientes]
"Aunque en las experiencias con personas vivas no parecía que hubiera esa tempestad inmunológica, a nivel microbiológico es posible que ya estuviera pasando", cavila el experto español. "Los órganos quedaban dañados y, si no se corregían, tenían sus días contados".
Matesanz recuerda que los órganos de cerdo utilizados en estos experimentos tenían 10 modificaciones genéticas, mientras que el del primer paciente vivo con un riñón porcino acumulaba 69 modificaciones.
"El camino de estas modificaciones son una especie de ensayo y error, como si estuvieran construyendo un rompecabezas: primero quieren evitar el rechazo, luego la inflamación, la trombosis, etc."
Para él, es evidente que estas modificaciones no son suficientes, pero también que hay que plantear otra manera de afrontar el xenotrasplante. "Algo tiene que cambiar para pensar que el rechazo está controlado. Ahora mismo no lo está y, si seguimos haciendo las cosas como hasta ahora, difícilmente podremos conseguir resultados distintos a los que estamos teniendo".