
Ejemplares adultos de Bemisia tabaci. Wikimedia Commons
Ésta es la mosca que robó un "superpoder" y ahora es una de las peores plagas
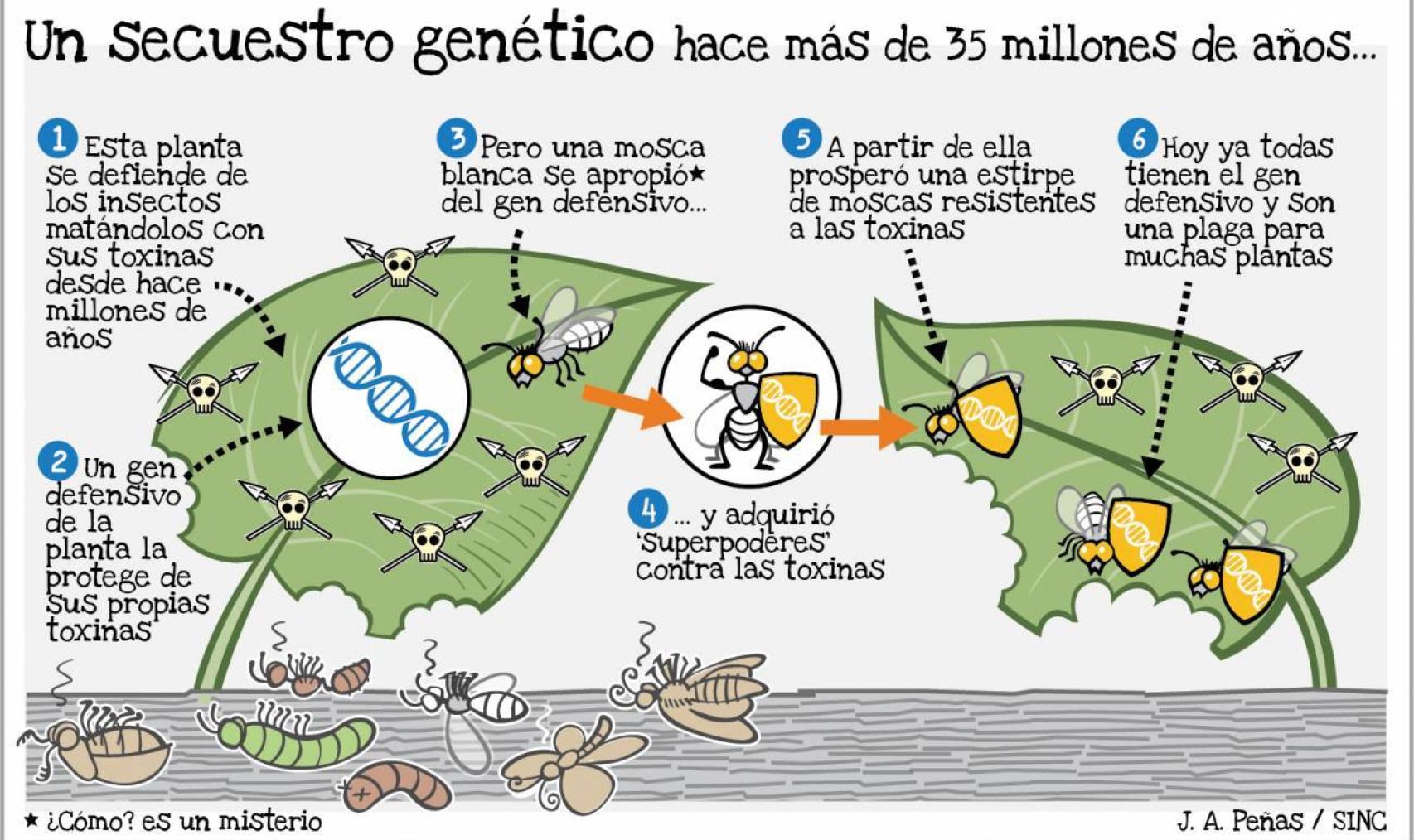
Hace 35 millones de años, un gen de autodefensa pasó de un vegetal a una mosca, que ahora es una plaga inmune a pesticidas naturales.
Noticias relacionadas
Hace algo más de 35 millones de años tuvo lugar un secuestro genético determinante e inusual. De alguna manera, un gen de autodefensa de una planta pasó al interior celular de una mosca blanca. Una vez dentro, allí se quedó y desde allí se heredó hasta que a todas ellas se extendió.
Desde entonces, la mosca blanca usa su función como escudo y es capaz de resistir los ataques que muchas plantas lanzan contra toda suerte de insectos. Hoy, y en virtud de ese gen, la mosca blanca es una de las plagas más destructivas del mundo.
El secuestro es un caso de lo que se conoce en la jerga como transferencia genética horizontal. Esta supone que el paso de material genético no se dirige a los descendientes, como ocurre de la forma tradicional y vertical, sino a compañeros del entorno.
En algunos casos el resultado es un salto evolutivo casi inmediato y se entiende con la comparación que hizo la microbióloga Lynn Margulis: “Es algo así como ir a una piscina, entrar con los ojos marrones y salir con ojos azules, solo porque has tragado agua”. Es muy habitual entre microorganismos, pero muchísimo más raro en células como las de plantas o animales.
Esta es la primera vez que se describe un salto así y con una función tan evidente entre una planta y un animal. El estudio inaugural se publica en la revista Cell y, en palabras de Charles Davis, biólogo evolutivo en la Universidad de Harvard, “es realmente genial”.
La lanza y el escudo
“Ha habido mucho debate en los últimos años sobre si algo así se producía realmente en células eucariotas (como las de plantas y animales)”, reconoce Luis Boto, biólogo evolutivo en el Museo de Ciencias Naturales del CSIC en Madrid y que lleva años investigando este tipo de transferencias.
“El nuevo estudio demuestra claramente y de forma detallada que puede suceder. Además, por primera vez se comprueba el salto de un rasgo por transferencia horizontal de una planta a un animal, superando las barreras y dotando a este de una defensa frente al material armamentístico de aquella”.
Los investigadores ni siquiera estaban buscando algo así. Lo que trataban de hacer era averiguar de forma general qué permitía a la mosca blanca campar a sus anchas, alimentarse sin complejos de la savia azucarada de cientos de plantas que a otros insectos les resultan más o menos tóxicas. Y provocar, de paso, plagas que destruyen multitud de cultivos con enormes consecuencias económicas.
La mosca que adquirió un gen de una planta. Agencia SINC
Los pesticidas naturales de muchas plantas reciben el nombre de glucósidos fenólicos, moléculas que consisten básicamente en un azúcar unido a un ácido. Los investigadores buscaron en el genoma de la mosca qué les podría estar ayudando a resistir su ataque y que, a la vez, no estuviera en otros parientes más o menos próximos. El gen que encontraron y que mejor pinta tenía se llama BtPMaT1. Y he ahí donde estaba la sorpresa.
El gen contiene las instrucciones para fabricar una proteína que añade un grupo químico a los pesticidas, volviéndolos inofensivos. Pero no solo no estaba en otros insectos, sino que no tenían siquiera ningún otro que se le pareciese y que la evolución hubiera ido modificando. ¿De dónde venía, entonces?
Francis Mojica identificó el origen vírico de las secuencias CRISPR en su ordenador, cortando y pegando letras en diferentes bases de datos. Eran los tiempos anteriores a la explosión de internet. Ahora, los investigadores lanzaron una búsqueda mucho más potente de secuencias similares a la del gen en multitud de bibliotecas de genomas. Las encontraron, pero solo estaban en plantas. La arqueología genómica les ha permitido establecer que el insecto tomó el gen en algún momento hace entre 35 y 80 millones de años y a partir de entonces se extendió. Cómo y de qué planta lo hicieron no lo saben aún, aunque bien podría haber sido a través de un virus, sospechan.
A partir de ahí hicieron toda una serie de comprobaciones. Vieron que el gen estaba integrado en el genoma del insecto, como uno más. Que trabajaba, sobre todo en el intestino, y que funcionaba como habían predicho. En lugar de esperar a que la evolución pudiera generar y amparar cambios desesperadamente lentos y graduales, que no podía prometer, la mosca blanca engulló un gen y esquivó miles de años de un bocado. Entró y salió de la piscina de Margulis.
“Es una muestra de que la evolución puede incorporar genes de otros organismos y que pueden ayudar a sobrevivir mejor”, ha dicho Ted Turlings, uno de los coautores. “Este caso es algo extremadamente raro, pero si tenemos en cuenta que hablamos de miles de millones de insectos y plantas interaccionando durante millones de años, se vuelve más posible”.
En realidad no es el primer caso que se encuentra. Justo unos meses antes, investigadores colombianos describieron otro gen que había saltado de una planta a la propia mosca blanca. La diferencia es que, de momento, no han podido demostrar que esté cumpliendo una función.
BtPMaT1 parece que sí lo hace. Los investigadores diseñaron un original experimento para ver hasta qué punto le era útil a la mosca. Generaron una planta de tomate transgénica que produjera un ARN particular, un ARN que inactivara el gen cuando las moscas comieran de ella. A la semana de iniciar el experimento, casi el 100 % habían muerto. En el mismo tiempo, apenas el 20 % de las que comían de una planta normal lo hicieron. El gen les resulta crucial.
Al mismo tiempo, la modificación no afectó a otros insectos y animales con quienes la probaron ni a la propia planta, que utiliza el gen para defenderse de sus propias toxinas. Esto es así porque el gen de la mosca se parece mucho al suyo, pero el tiempo lo ha modificado como para ser suficientemente diferente. El ecólogo Jonathan Gersenzhon comenta en la revista Nature que eso abriría puertas a nuevas formas de controlar las plagas y que “ofrece una oportunidad enorme. Podrías mantener alejadas a las moscas blancas pero sin dañar a insectos beneficiosos como los polinizadores”.
Los autores se muestran necesariamente más cautos en su artículo. Lanzan esa posibilidad, pero reconocen que todavía habría que investigar mejor las consecuencias de la modificación en la propia planta y en otros organismos.
Y, en medio de comentarios técnicos sobre los experimentos, se reservan seis líneas para comparar su descubrimiento con la historia del filósofo chino Han Fei y que dio origen al término paradoja (en chino: “lanza-escudo”). La historia dice así:
“En el Reino de Chu vivía un hombre que vendía lanzas y escudos.
—Mis escudos son tan sólidos —se jactaba—, que nada puede traspasarlos. Mis lanzas son tan agudas que no hay nada que no puedan penetrar.
—¿Qué sucedería si una de tus lanzas choca con uno de tus escudos? —le preguntaron.
El vendedor no supo qué decir”.
La respuesta de la mosca blanca fue robar el escudo.
La transferencia horizontal y su repercusión
Una de las primeras sospechas de que la transferencia horizontal existía se tuvo en 1928, cuando en el conocido como “experimento de Griffith” se vio que una cepa inofensiva de neumococo podía transformarse en muy peligrosa cuando entraba en contacto con otra cepa virulenta.
Luego, en los años 50 se demostró que las bacterias podían traspasarse genes de resistencia a antibióticos y el conocimiento se fue acumulando, llegándose incluso a plantear debates sobre la importancia del mecanismo en toda la historia de la evolución y la vida.
En muchos microorganismos la transferencia horizontal sucede constantemente y de varias maneras. Pueden intercambiarse secuencias por pequeñas antenas llamadas ´pili´ y que ponen en contacto unos con otros, pueden recogerlas del ambiente o usar intermediarios como los virus.
En células eucariotas, como las de plantas y animales, es mucho más difícil. Esto es así porque “hay que superar muchas barreras”, explica Boto. Por ejemplo, “deben atravesar la membrana del núcleo, donde está el ADN (y que las bacterias no tienen). Y, en general, debe suceder en las células sexuales para que luego pueda pasar a la descendencia”.
Aun así, hay ejemplos aceptados de que esto ha sucedido en ocasiones. Generalmente a partir de bacterias, como las que han dado genes a muchas algas o como la que le donó uno al insecto barrenador del café y le permitió digerir mejor las células vegetales. Pero no solo han sido ellas: en algún momento, un hongo le regaló un gen a una variedad de trigo silvestre y ahora resiste mejor ciertas infecciones. Otro hizo que el pulgón verde del guisante pudiera ser rojo.
Si sucede en animales, por diferentes razones estos suelen ser microscópicos, de reproducción no sexual —como los gusanos que lo pueden hacer por fragmentación— o insectos. “Pero no solamente”, precisa Boto, “hace poco se ha descrito un caso entre peces de diferentes especies, facilitado probablemente porque liberan los huevos al agua y la fertilización es externa”.
En los humanos, un estudio aseguró haber encontrado en nuestro genoma 145 genes de otras especies y tipos de célula, todos ellos adquiridos antes de que fuéramos propiamente humanos, hace millones de años. Sin embargo, el hallazgo “es muy controvertido”, asegura Boto, y el trabajo ha sido bastante criticado. En cualquier caso, “no es descartable que en el futuro pueda confirmarse algún caso”.
Lo que sí hemos incorporado son fragmentos de virus. Al menos un 8 % de nuestro ADN es de origen vírico, y aunque en su mayoría no son genes como tales, su papel no es irrelevante. ¿Se considera entonces transferencia horizontal? Aunque hay veces en que se acepta, “es casi un tema filosófico”, apunta Boto. “Si consideramos que tiene que darse entre organismos vivos, no está claro que un virus lo sea”.
¿Qué esperar entonces, a partir de ahora? ¿Estamos viendo la punta del iceberg de la transferencia horizontal fuera de los microorganismos o no quedan ya muchas sorpresas por emerger? “Es muy posible que aparezcan novedades”, responde Boto.
“El tiempo y el uso generalizado de las nuevas técnicas nos darán una medida de su extensión. Pero por pocos casos que sean, pueden ser muy importantes, porque facilitan la adquisición de rasgos de una forma muy rápida. Lo acabamos de ver con el ejemplo entre una planta y una mosca”.
Volviendo al artículo original, el biólogo evolutivo Andrew Gloss se lanza en la revista Nature y apunta a una historia ecológica trufada de crossovers: "Que los insectos reciban genes de las propias plantas es esa última parte del arsenal que aún no habíamos encontrado", dice. "En la batalla entre las plantas y sus plagas de insectos o patógenos, hay genes que se extraen de todo el árbol de la vida".



