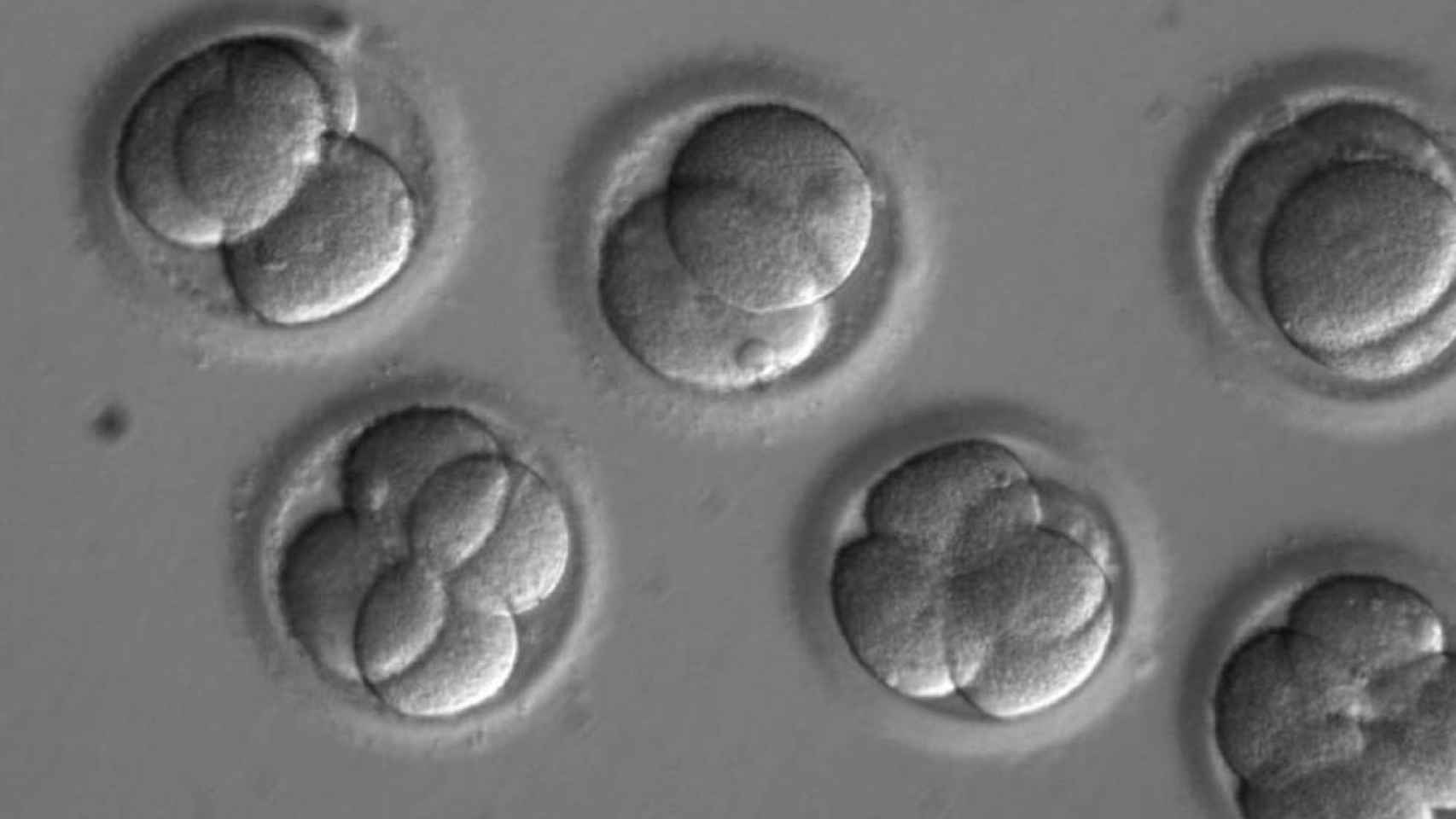
Un equipo internacional de científicos ha logrado por primera vez, mediante técnicas de edición genética, corregir en embriones la mutación del gen que causa miocardiopatía hipertrófica, una enfermedad hereditaria que afecta a una de cada 500 personas y es la causa más común de muerte súbita en atletas.
La técnica, que usa el sistema de edición genética CRISPR-Cas9, corrigió el error en la etapa más temprana del desarrollo embrionario; esto evitaría su transmisión a generaciones futuras.
Los resultados se publican en Nature y sus autores aseguran haber cumplido con todas las consideraciones éticas de la Academia Nacional de Ciencias de EEUU sobre técnicas de edición genética -los experimentos con embriones se realizaron en centros de ese país-. Estos se mantuvieron con vida unos pocos días y nunca se desarrollaron pensando en su implantación.
Los científicos, entre ellos el español Juan Carlos Izpisúa Belmonte, del Laboratorio de Expresión Genética del Instituto Salk (California) recalcan que, aunque se trata de resultados prometedores, estos son preliminares y es necesaria mucha más investigación para asegurar que no se produzcan efectos no deseados.
También participa la Universidad de Salud y Ciencias de Oregón, el Instituto de Ciencias Básicas de Corea del Sur y el laboratorio de ingeniería para la innovación de diagnóstico molecular BGI-Qingdao y Shenzhen (China).
No es la primera vez que se publica un artículo sobre edición genética en embriones. Hasta ahora lo habían hecho equipos chinos, pero sí que es la primera vez en EEUU, con unos resultados que prueban que el procedimiento es "más efectivo y seguro" de lo pensado, resume a Efe vía correo electrónico Izpisúa. Y es que a diferencia de los anteriores trabajos, aquí se usa una metodología distinta que favorece la generación de embriones sanos.
Cómo lo han hecho
Para llevar a cabo los experimentos se generaron embriones nuevos, no se utilizaron como hasta ahora embriones sobrantes de procesos de fecundación in vitro: se produjeron cigotos fertilizando ovocitos sanos con esperma de un donante portador de una mutación en el gen MYBPC3 (causa miocardiopatía hipertrófica). Quien tiene una copia mutada de este tiene un 50 % de probabilidades de transmitirlo a sus hijos.
Otra de las novedades es el momento en el que se usó CRISPR-Cas9, una técnica que permite cortar el genoma donde se quiere para después repararlo -son unas tijeras moleculares programables 'hechas' de proteínas y pequeñas secuencias de ARN-.
Las usaron de dos formas, administrándolas después de la fecundación, como en anteriores trabajos, y antes, introduciéndolas a la vez que el esperma en el óvulo; esta última fórmula es la que provocó los resultados más sorprendentes, según los autores.
Cuando se corta un gen, en este caso MYBPC3, se activan los sistemas de reparación endógenos que tenemos en nuestras células y en estos experimentos es lo que ocurrió, pero con mejoras.
"Después de que CRISPR hiciera el corte, el embrión inició sus propias reparaciones, pero en lugar de utilizar la plantilla de ADN sintético suministrada lo hizo usando preferentemente la copia saludable del gen aportada por la madre, lo que fue una sorpresa", señala en una nota del Instituto Salk Jun Wu, otro de los firmantes.
No solo se repararon un alto porcentaje de células embrionarias, sino que la corrección no indujo otras mutaciones ni inestabilidad en el genoma: lograron que el 72% de los embriones portaran dos copias sanas del gen, según una nota del centro coreano.
Una mejora de las fecundaciones 'in vitro'
Los investigadores son conscientes de que el diagnóstico genético preimplantacional (DGP) -estudia los embriones antes de implantarlos-, es una fórmula válida para evitar aquellos con mutaciones, pero este trabajo contribuye a mejorar las fecundaciones 'in vitro' porque se aumentaría el número de embriones sanos listos para implantar.
También sería la solución cuando las copias de los genes del padre y la madre tuvieran la misma mutación, apunta Izpisúa, quien indica a Efe que se ha demostrado "eficacia y seguridad por primera vez en embriones humanos, por lo que se abre la puerta a que esta tecnología pudiera llevarse alguna día a la clínica, obviamente con todas las precauciones necesarias y siempre que hubiera consenso social y la ley lo permitiera".
Lluís Montoliu, miembro del Comité de Ética del CSIC, valora este trabajo: "Que CRISPR funciona en embriones humanos ya lo sabíamos, pero la innovación ahora es precisamente la fórmula utilizada, que consigue promover la corrección a partir de la copia de la madre".
"Ellos nos descubren un sistema de reparación no conocido", subraya Montoliu, para quien hay que seguir siendo "muy prudentes" antes de la clínica y hacer más estudios; "aunque este artículo nos haga reflexionar, mientras sigan existiendo estrategias más sencillas, como el DGP, no aplicaría por prudencia la edición genética en embriones".