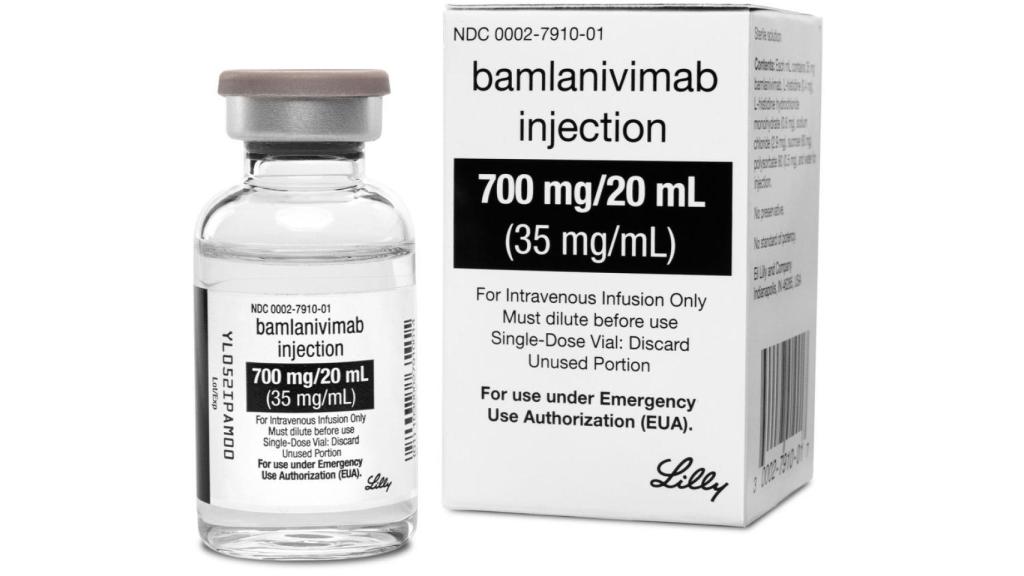
Bamlanivimab .
EEUU aprueba este caro y prometedor fármaco anti-Covid: el primero para no hospitalizados
El bamlanivimab, un fármaco elaborado con anticuerpos del coronavirus Sars CoV-2, está recomendado para pacientes recién diagnosticados.
10 noviembre, 2020 07:59Noticias relacionadas
- Así son los ensayos clínicos con los que las farmacéuticas buscan probar la eficacia de la vacuna de la Covid-19
- Los médicos 'desconocidos' que salvaron de morir a miles de personas en la primera ola de la Covid
- El ‘superinmune' Fermín: el plasma de sus venas es un tesoro que ya salva vidas a enfermos de Covid
La Agencia de Alimentos y Medicamentos de Estados Unidos (FDA, en inglés) concedió este lunes una autorización de urgencia a la terapia experimental con anticuerpos contra la Covid-19 de la farmacéutica Eli Lilly, similar a la de Regeneron. El Gobierno de Donald Trump ya anunció a finales de octubre la compra de 300.000 dosis de este fármaco, llamado bamlanivimab.
Se trata de una terapia con anticuerpos indicada para pacientes recién diagnosticados con coronavirus y que no han sido hospitalizados o requieren de oxígeno, ya que todavía no hay resultados sobre si es también beneficioso en este tipo de personas. Sí se ha demostrado eficaz en personas mayores de 65 años y con patologías crónicas, los grupos más afectados por la Covid-19.
"Si bien se sigue evaluando la seguridad y eficacia de esta terapia experimental, en ensayos clínicos se ha demostrado que bamlanivimab reduce las hospitalizaciones o las visitas de emergencias relacionadas con Covid-19 en pacientes con alto riesgo", indicó la FDA en un comunicado.
Uno de los ensayos que ha llevado a esta aprobación es el bautizado como BLAZE-1, prublicado a finales de octubre en la prestigiosa revista The New England Journal of Medicine.
En dicho trabajo, se demostró que los pacientes recién diagnosticados -o con un diagnóstico temprano- de Covid-19 que recibían el medicamento -que se administra como infusión intravenosa en una única dosis-, redujeron su carga viral más rápido que el grupo placebo, presentaron síntomas menos graves y tuvieron que ir menos a Urgencias.
Ahora, la farmacéutica estadounidense tendrá que hacer entrega al Gobierno de las 300.000 dosis adquiridas por 375 millones de dólares en un plazo de dos meses, según se informó en octubre tras la firma del contrato.
El acuerdo fue firmado como parte del programa Warp Speed [Velocidad de vértigo en inglés], que tiene la intención de conseguir en tiempo récord vacunas y terapias contra la pandemia del nuevo coronavirus. Trump durante su convalecencia hace aproximadamente un mes dijo que la terapia de Eli Lilly era una de las más prometedoras para hacer frente a la pandemia.
El presidente saliente fue tratado entonces con una terapia de anticuerpos de Regeneron, que también ha solicitado autorización de urgencia, y con el antiviral Remdesivir de Gilead Sciences, que recientemente obtuvo la autorización definitiva para tratar a enfermos de covid-19.
Esta autorización de urgencia llega el mismo día en el que Estados Unidos ha superado los 10 millones de contagios de coronavirus y suma ya más de 238.000 muertes, más que ningún otro país en el mundo. También este lunes la farmacéutica Pfizer anunció que los ensayos de su vacuna contra la covid-19 han demostrado una eficacia de más del 90 %.