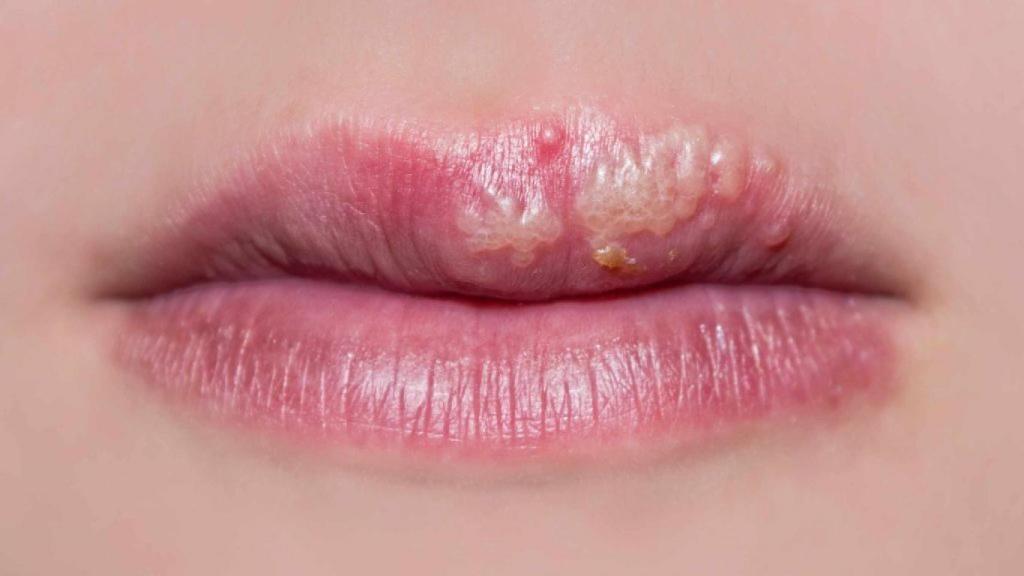
Una mujer afectada por un herpes labial.
Revelado el mayor secreto del herpes: descubren por qué lo sufrimos para toda la vida
La descripción del mecanismo por el que el herpes se hace fuerte en el sistema nervioso abre la puerta al desarrollo de vacunas preventivas.
17 noviembre, 2021 17:18Noticias relacionadas
Más de la mitad de los adultos en España están infectados por el virus del herpes simple de tipo 1 (VHS-1), una prevalencia que aumenta al 67%, más de 3.700 millones de personas en todo el mundo, según reveló un informe publicado en PLOS One en 2015. El VHS-1 se contagia principalmente por contacto boca a boca, recoge la Organización Mundial de la Salud (OMS), y se manifiesta generalmente como herpes labial.
La característica más importante del herpes es su persistencia: aunque se trate y desaparezca en la piel, el virus hibernará en el sistema nervioso periférico, de dónde nunca puede ser erradicado. Ahora, un trabajo de investigadores de Northwestern Medicine (EEUU) que publica la revista Nature asegura haber desentrañado su estrategia de ocultación, lo que abriría la puerta al desarrollo de una vacuna que también podría prevenir a su 'primo', el VHS-2 o herpes genital.
Aunque la gran mayoría de los portadores no sufrirán síntomas más graves que la conocida como 'calentura' labial, el herpes simple puede afectar a otros tejidos, lo que puede llegar a acarrear ceguera o graves casos de encefalitis. Según los autores, también hay evidencias de que contribuye a desencadenar enfermedades neurodegenerativas como la demencia. El VHS-2, por otra parte, puede contagiarse de madre a hijo durante el parto y provocar herpes neonatal. Es una patología tratable, pero puede dejar secuelas e incluso resultar letal.
"Necesitamos de forma desesperada una vacuna para evitar que el herpes invada el sistema nervioso", explica el Dr. Greg Smith, profesor de Microbiología e Inmunología de la Escuela de Medicina Feinberg de la Northwestern University. Su laboratorio ha dejado al descubierto la forma en la que el virus se infiltra. Según lo explican, 'secuestra' una proteína de las células epiteliales en un fenómeno de "asimilación" que le permite "viajar" por el sistema nervioso periférico.
"El virus necesita inyectar su código genético en el núcleo de la célula para replicarse", explica Smith. "De este modo la reprograma para convertirla en una fábrica de virus. La gran pregunta es: ¿cómo entra en el núcleo de una neurona?". La vía de entrada serían los microtúbulos de la célula, y se impulsaría gracias a dos proteínas motoras, la dineína y la kinesina, que iría "asimilando" a medida que se traslada célula a célula en dirección hacia el núcleo de la neurona.
"Ahora que sabemos cómo el virus consigue realizar la proeza de 'colarse' en nuestro sistema nervioso, podemos pensar en maneras de impedírselo", valora el investigador. "Si pudiéramos evitar que asimilara la kinesina, lograríamos inutilizar su capacidad para infectar al núcleo. Y de esta manera tendríamos una candidata a vacuna preventiva".
Smith invita a pensar en los microtúbulos como una red ferroviaria que conduce a un nodo central, el centrosoma. La dineína sería la 'energía' que impulsaría el movimiento hacia el centro, mientras que la kinesina iría hacia la periferia. Cuando un virus como el de la gripe infecta a las células epiteliales de la mucosa de la boca y nariz, se impulsa con ambas proteínas motoras desplazándose al azar hasta que llega "más o menos de chiripa", explica, al centro.
Sin embargo, el viaje del herpes a través del sistema nervioso es mucho más complejo. Es capaz de usar la dinesina para dirigirse al núcleo al tiempo que evita que la kinesina le aleje de vuelta. "Es un trayecto muy largo", confirma Smith. "Probablemente tarde ocho horas en llegar desde un extremo de la neurona hasta su centrosoma".
El motor de dineína no podrá pasar del centro, y no permitirá al virus infiltrarse en el núcleo. Será entonces cuando el herpes utilizará la kinesina que ha asimilado y que, "en un acto de traición", le permitirá introducir su material genético en el corazón de la célula.
"Es la primera vez que observamos a un virus reutilizando una proteína celular para impulsar el proceso de infección", reume la primera autora, Caitlin Pegg. "Es emocionante desentrañar los mecanismos moleculares que han permitido a estos virus evolucionar hasta convertirse en los patógenos más eficaces".





