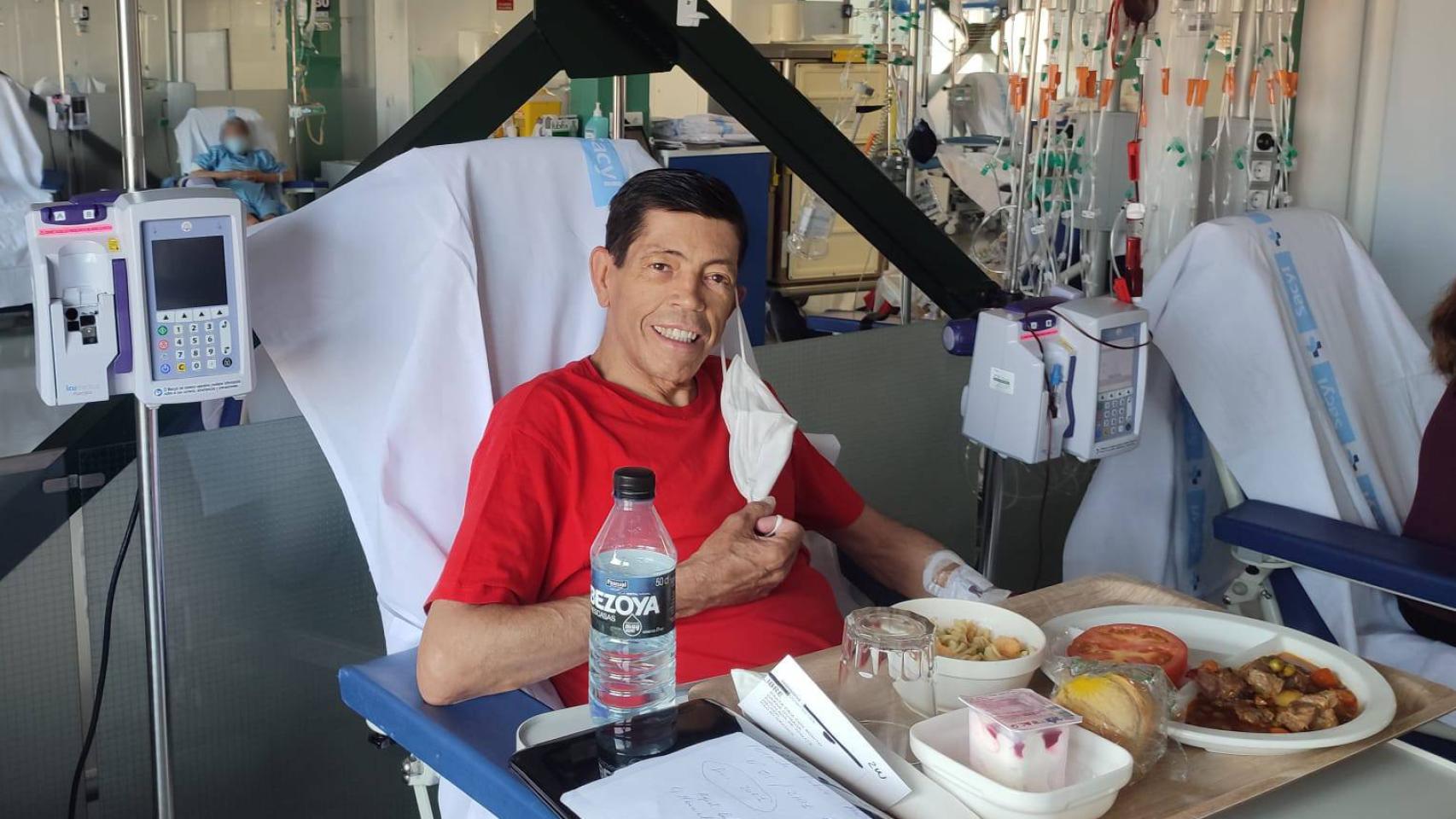
Secundino Sacristán acude al hospital una vez cada 15 días para recibir una trasfusión. Cedida
Cuánto vale una vida: España estudia si pagar 2 millones por un fármaco para hasta 1.400 pacientes
La aprobación europea de una terapia con potencial curativo en dos enfermedades graves abre incertidumbres sobre si España podrá pagarlo.
18 febrero, 2024 01:12¿Cuánto vale una vida humana? La aprobación del primer medicamento basado en la tecnología de edición genética CRISPR llena de esperanza a los pacientes y de incertidumbre a los gestores: tiene la capacidad de curar una enfermedad potencialmente mortal pero su elevado coste pone en peligro los presupuestos de sanidad de hospitales, comunidades y del propio estado: ¿quién puede pagar 2 millones por cada una de las 1.300 personas con anemia de células falciformes que hay en España?
"Vertex ya está trabajando codo con codo con las autoridades nacionales de salud para asegurar el acceso a pacientes elegibles tan pronto como sea posible", reza la nota de prensa de Vertex, la compañía que ha desarrollado Casgevy, el primer fármaco comercial que utiliza la tecnología de corta-pega genético que le hizo ganar a Jennifer Doudna y a Emmanuelle Charpentier el Premio Nobel de Química en 2020.
Es posible que, en los últimos años, usted haya oído hablar en multitud de ocasiones de las siglas CRISPR. Se trata de una técnica de defensa frente a los virus de algunos microorganismos descubierta por el español Francis Martínez Mojica y que Doudna y Charpentier demostraron que podía aplicarse para editar ADN de una forma asombrosamente sencilla.
[Llega la revolución de los fármacos de edición genética 70 años después de la doble hélice del ADN]
Hasta el momento, la revolución que supone CRISPR no había salido del laboratorio pero Casgevy marca el primer paso de su uso en la salud humana.
El fármaco está indicado para pacientes mayores de 12 años con beta talasemia o anemia de células falciformes. Ambas son enfermedades causadas por una mala conformación de las proteínas de la hemoglobina, que impide su función óptima y puede ocasionar graves y dolorosos daños en las personas que la sufren.
Vertex se alió con CRISPR Therapeutics, compañía que fundó Charpentier para aprovechar el potencial de la nueva tecnología, para desarrollar el fármaco. De forma resumida, consiste en extraer y modificar las células madre hematopoyéticas del paciente (las que dan lugar a los componentes de la sangre) para que fabriquen la versión correcta de la hemoglobina usando la tecnología CRISPR.
[Paco, el burgalés de las 500 donaciones de sangre, récord de Europa: "Tengo un callo en la vena"]
Hasta ahí, todo bien. El problema viene cuando el fármaco maravilloso, la panacea para 8.000 personas de toda Europa —el cálculo es de la propia Vertex— sale por 2,2 millones de dólares por paciente. Ese es el precio del medicamento en EEUU, donde se aprobó el pasado 8 de diciembre. En Reino Unido, país que primero autorizó el fármaco, se desconoce. En España tardaremos en saberlo.
"Es inhumano decirle a una persona: no te podemos curar porque vale mucho el medicamento", sostiene Secundino Sacristán, miembro de la junta directiva de la Asociación Española de Lucha contra las Hemoglobinopatías y Talasemias.
Con 59 años y varios órganos deteriorados por la enfermedad, apunta que quizá él no pueda ser candidato ya a recibirlo "pero para los chicos jóvenes no puede ser una traba".
"Dijeron a mis padres que iba a morir"
La vida de Sacristán no ha sido fácil. A los 6 años, viendo que en el colegio apenas podía moverse y se cansaba al subir dos escaleras, sus padres le llevaron a Madrid desde un pueblo de Valladolid para averiguar qué tenía su hijo.
"Siempre había estado malo, nunca corría, estaba muy pálido, sin energía", explica. "A mis padres les dijeron que tenía una talasemia, que era una enfermedad hereditaria, y que me iba a morir: no había solución, ni siquiera en el extranjero".
Comenzó a recibir trasfusiones. Primero, cada poco más de un mes. A medida que se iba a haciendo mayor se fue acortando ese tiempo y ahora recibe una cada 15 días. Toma unas 20 pastillas diarias —"para el corazón, diuréticos, para hipertensión pulmonar, la quelación del hierro, ácido fólico..."— y se ha sometido a numerosas intervenciones quirúrgicas, entre ellas, la extirpación del bazo y la vesícula. "A todos los talasémicos, normalmente, se los quitan, pero a mí me han hecho, además, más operaciones".
Sacristán es miembro de Alheta, asociación de pacientes con talasemias. Cedida
Salvador Payán, hematólogo del Hospital Virgen del Rocío de Sevilla, recuerda el caso de una paciente de beta talasemia dependiente de trasfusiones que murió con 22 años, "por un fallo cardíaco debido a sobrecarga de hierro, hace 7 años, es decir, una época con todas las herramientas terapéuticas actuales".
El paciente más joven de drepanocitosis (así se llama también a la enfermedad de células falciformes) que ha visto morir "era un niño de 11 años, debido a un ictus,una manifestación muy frecuente de la enfermedad, hace dos años".
Payán, que además es miembro del grupo de Eritropatología de la Sociedad Española de Hematología y Hemoterapia (SEHH), refiere también casos de un paciente que necesitó una prótesis de cadera antes de los 20 años, otros con "intenso dolor crónico", otros que ingresan varias veces al año, "otros con úlceras crónicas en los tobillos que les impiden carminar durante largas temporadas", otros en diálisis... y así una larga lista de graves problemas causados por ambas enfermedades.
[El fin del sueño de la inyección de sangre joven para rejuvenecer: inútil y dañina para el donante]
El Registro Español de Hemoglobinopatías y Anemias Raras de la SEHH y la SEHOP (la Sociedad Española de Hematología y Oncología Pediátricas) llevaba incluidos hasta junio del año pasado un total de 1.317 pacientes de enfermedad de células falciformes y 115 de talasemia dependiente de trasfusiones. Es decir, algo más de 1.400 personas, "pero muchos pacientes no están incluidos en este registro", por lo que el número de potenciales candidatos al tratamiento es superior.
Antes de la llegada de este nuevo fármaco muchos se podían curar con un trasplante de médula, generalmente con un hermano como donante, pero en muchas ocasiones falta el donante adecuado "y los riesgos de este procedimiento limitan su aplicación a una minoría de enfermos. Los riesgos son mayores conforme avanza la edad, por lo que generalmente se reserva a niños y adolescentes".
Para el resto no hay opciones similares hasta ahora. Con todo, está por decidir quiénes de ellos recibirán el fármaco. La indicación apunta (siempre en mayores de 12 años) a las personas candidatas a trasplante pero sin donante adecuado y, en el caso de la drepanocitosis, que tengan crisis vasooclusivas recurrentes, "unos episodios repentinos de dolor muy intenso en varios huesos simultáneamente, que a menudo requieren ingreso". Por tanto, "con los citados criterios, solo una minoría de pacientes con ambas enfermedades sería candidata a recibir la terapia génica".
Los fármacos más caros de España
¿Cuánto vale una vida humana? La pregunta al principio de este reportaje se puede transformar en ¿cuánto está dispuesta a pagar la sanidad pública por un medicamento, por bueno que sea?
Casgevy no es el primer fármaco que se puede calificar como extremadamente caro. En la última década ha sido un no parar de récords de precios de medicamentos. En 2014 llegó Sovaldi, un comprimido muy eficaz contra la hepatitis C (en muchos casos se podía hablar de curación) pero cuyo coste, de más de 70.000 euros por tratamiento, generó una gran polémica sobre hasta dónde estaban las administraciones dispuestas a pagar.
En 2018 llegaron las CART, tratamientos de terapia celular que se administran de forma similar a Casgevy: se extraen células madre hematopoyéticas, se modifican genéticamente y se reintroducen en el paciente. En varios tipos de cáncer hematológico han conseguido supervivencias nunca vistas anteriormente. Pero su precio, superior a los 300.000 euros, marcó un nuevo hito en la sanidad española.
[Así es el medicamento más caro del mundo: vale 2 millones de euros y tratará a 20 niños en España]
Este récord no duró mucho. Luxturna, terapia génica dirigida a distrofias de la retina, llegó poco después con un coste superior a los 350.000 euros. Y a finales de 2021 apareció Zolgensma, terapia para la atrofia muscular espinal, cuyo precio se estimaba en dos millones de euros.
Muchos de estos precios, en realidad, son orientativos porque en España la negociación del precio de los fármacos es alto secreto.
"Hay dos precios, el notificado y el financiado", explica Eduardo López Briz, jefe de sección en el servicio de Farmacia del Hospital La Fe de Valencia y coordinador del grupo Genesis, de evaluación de medicamentos, de la Sociedad Española de Farmacia Hospitalaria (SEFH).
[Estos son los medicamentos del futuro: caros en fabricación pero más eficaces]
"El notificado es el oficial y público, y suele ser el mismo o parecido al que se ha registrado en otros países europeos. El financiado es al que se llega tras negociar con los ministerios (de Sanidad, Hacienda, Economía e Industria) y ese no es público para evitar que en otros países lo tomen como referencia".
De hecho, muchos de los precios mencionados anteriormente no han sido públicos hasta que asociaciones como No es sano y fundaciones como Civio han logrado publicarlos mediante peticiones a Transparencia o, en muchas ocasiones, litigios con el Estado.
Gracias a estas acciones sabemos que el precio final de estos medicamentos es algo 'menor': 221.000 euros en el caso de Luxturna o 1,34 millones para Zolgensma, sin incluir el IVA.
Umbrales de coste-efectividad
¿Cuál es el precio justo para un medicamento? Depende de muchos factores, por supuesto. Distintos países han intentado elaborar un marco objetivo de lo que es razonable pagar por un fármaco. Es lo que se conoce como umbral de coste-efectividad, es decir, a partir de qué precio no merece la pena pagar por un fármaco.
La respuesta, claro está, no es fácil. No se trata solo del beneficio del fármaco en comparación con sus efectos secundarios: eso ya lo establecen los ensayos clínicos previos a su autorización.
Aquí se tiene en cuenta el beneficio respecto a las terapias existentes, respecto al ahorro en la atención sanitaria (ingresos en el hospital, intervenciones quirúrgicas y otros gastos) y respecto a lo que es aceptable sustraer de otras partidas —los presupuestos siempre son limitados y pero la demanda no— para dedicarle a unos pocos pacientes.
Numerosos estudios han intentado establecer un umbral de precios a partir del cual ya no merece la pena pagar un fármaco o una tecnología sanitaria nueva. Se suelen calcular por cada año de vida ajustado a calidad (AVAC), es decir, tiempo de vida sin discapacidad ganado gracias al medicamento.
La OMS sugiere que un umbral razonable estaría entre 1 y 3 veces el PIB per capita de un país, lo que da un amplio rango de precios. En EEUU, por ejemplo, clásicamente se estimaba un límite de 50.000 dólares por AVAC aunque algunas propuestas lo elevan a 175.000. En Australia, unos 76.000 dólares; en Canadá, 100.000.
Sin embargo, solo un país ha establecido umbrales de forma oficial. Reino Unido, que es el espejo en el que se miran todos los gestores en políticas de evaluación sanitarias, establece ese límite en entre 20.000 y 30.000 libras (23.000 y 35.000 euros, respectivamente) por cada año de vida ganado con calidad.
"El umbral se basaba en un análisis de los costes del trasplante renal frente a la hemodiálisis", explica López Briz, que recuerda que, aún así, el país ha creado una bolsa de financiación aparte para medicamentos oncológicos que superan ese umbral. "Quien toma la decisión de financiar o no, al final, es el político".
¿Y España? En 2016, un artículo revisó las numerosas propuestas que se han hecho para establecer un umbral justo de precios. Lo que hallaron fue desalentador: desde 1.000 euros a 5 millones por AVAC.
Con todo, apuntaban que 4 estudios "basados en el valor estadístico de una vida" obtenían como resultado entre 30.000 y 100.000 euros por año ganado, lo que iría en consonancia con las sugerencias de la OMS: el PIB español per capita son algo más de 30.000 euros anuales.
Cuánto vale una vida
En 2020, un grupo de investigadores, consultores, economistas de la salud y miembros de la industria farmacéutica estimaron un límite razonable en entre los 25.000 y 60.000 euros por AVAC.
Sin embargo, también advertían que el establecimiento de un límite oficial "podría contribuir a que los precios fijados por el ofertante se ajustasen al alza para que la razón de coste-efectividad incremental de la intervención llegase sistemáticamente hasta la máxima disposición a pagar".
Es decir, que si pones un límite 'invitas' a los laboratorios a reclamar ese mismo límite como precio de venta de su medicamento.
¿Merecen la pena los 2 millones de euros que podría costarle a la sanidad pública española cada paciente tratado con Casgevy? "Es difícil que el fármaco se ajuste, con ese precio, a cualquier umbral", sostiene López Briz.
"Nos faltan datos: no hay demasiados pacientes tratados en todo el mundo. El primer estudio se hizo con tres pacientes y hasta ahora se han tratado a poco más de 50. Pensamos que salva vidas, los pacientes han visto una mejora espectacular en los resultados clínicos, pero todavía no sabemos si se mantendrá la efectividad del tratamiento o aparecerán efectos adversos... Es una decisión difícil de valorar".
Por su parte, Salvador Payán considera que el alto precio que presumiblemente tendrá la terapia en nuestro país condcionará el acceso a las personas que lo necesiten, "tendremos que definir los criterios que deben reunir los pacientes candidatos".
El hematólogo recuerda que estas enfermedades ya representan un alto coste para las arcas públicas. "Muchos pacientes, por ejemplo, tienen reconocida legalmente la discapacidad y, en algunos casos más graves, hasta reciben una pensión no contributiva".
En Estados Unidos, solo un 28% de las personas con enfermedad de células falciformes tiene empleo "y la media de días laborables perdidos fue de 37. Y esto, si no mueren prematuramente". A estos costes, se añade, el que supone para cuidadores y familiares.
Payán apunta a varias propuestas para 'aliviar' el pago del fármaco. Con las CART, se paga la mitad del tratamiento al inicio y la otra mitad a los 18 meses... si el paciente sigue vivo. También hay techos de gasto: se calcula cuántos pacientes lo recibirían y es establece un tope. Existen pagos decredientes por volumen, por resultados clínicos... "En cualquier caso, hemos de tener una visión a largo plazo: estamos hablando de un tratamiento transformador para toda la vida".
Secundino Sacristán, que se jubiló a los 44 años porque su talasemia le impedía seguir trabajando, lo tiene claro. "¿Cuánto vale una vida? ¿Dos, tres millones de euros? No me cabe en la cabeza que, si podemos curar a una persona que está sufriendo, no lo hagamos".