Image: Las patologías del telómero
Las patologías del telómero
Describen por primera vez la función de los cromosomas en el ciclo celular
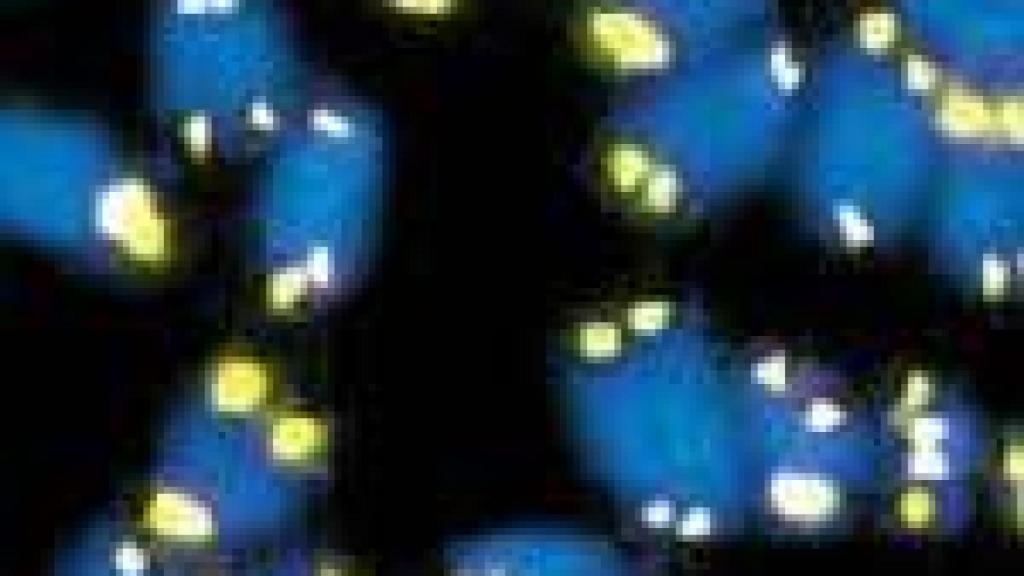
5 diciembre, 2002 01:00Imágenes de telómeros (en la imagen de color amarillo) al final de los cromosomas de ratón (en azul)
Procesos como el de envejecimiento, el cáncer o la clonación de mamíferos no pueden explicarse sin establecer la función de los telómeros. El hecho mismo de que las células normales del organismo carezcan de telomerasa y que los telómeros se pierdan es una de las posibles explicaciones de que seamos mortales. ¿Es la diana perfecta? ¿Puede hablarse de patologías del telómero? María Blasco, investigadora del Centro Nacional de Biotecnología (CSIC) ha dirigido un trabajo -publicado en "Nature Genetics" junto a Marta García-Cao y Susana Gonzalo- que pone en relación el tamaño de los telómeros y la vida de las células. Blasco analiza el hallazgo para El Cultural.
El final de los cromosomas
El extremo de los cromosomas eucarióticos está formado por unas estructuras llamadas telómeros. Los telómeros no contienen genes, sino que están formados de DNA repetido de secuencia TTAGGG.
Ya en los años treinta, Herman Möller y Barbara McClintock concluyeron que el "final de los cromosomas" era fundamental para proteger y estabilizar a los cromosomas. Así, cromosomas que perdían los telómeros eran inestables y se unían de manera aberrante a otros cromosomas, generando las llamadas "aberraciones cromosómicas", que a su vez provocaban la muerte celular.
Telómeros y envejecimiento
Uno de los descubrimientos más sorprendentes en relación a los telómeros fue publicado por Calvin Harley y Carol Greider en 1990, quienes vieron que las repeticiones teloméricas TTAGGG se perdían con la edad en todos los tejidos del organismo, con la excepción de la línea germinal. Harley y Greider propusieron que esta pérdida de telómeros limitaría la vida de las células del organismo, pues eventualmente desencadenaría una catástrofe cromosómica. Esta idea tiene profundas implicaciones en el entendimiento del envejecimiento como una consecuencia de la pérdida de telómeros con la edad. Pacientes de varios síndromes de envejecimiento prematuro, tales como el síndrome de Werner, la progeria de Hutchinson-Gillford, la Ataxia telangiectasia o la Disqueratosis congénita muestran una pérdida acelerada de telómeros.
En 1985, Elizabeth Blackburn y Carol Greider habían encontrado una actividad enzimática que era capaz de crear telómeros, a la que denominaron telomerasa. Harley y Greider vieron que la telomerasa estaba ausente en los tejidos del organismo adulto, excepto en la línea germinal que tenía altos niveles de telomerasa. Esto les permitió concluir que la actividad telomerasa era necesaria para que los telómeros se pudiesen mantener. Además, el hecho de que las células normales del organismo carezcan de telomerasa y que los telómeros se pierdan, es una de las posibles explicaciones de que seamos mortales. De hecho, la introducción artificial de telomerasa en células normales es suficiente para evitar la pérdida de telómeros y para permitir su crecimiento inmortal. Las implicaciones terapéuticas de estos descubrimientos son múltiples, por ejemplo, si conseguimos "refrescar" los telómeros de pacientes envejecidos prematuramente mediante la introducción de telomerasa, podríamos ser capaces de alargar su vida, o por lo menos de corregir algunas de las patologías asociadas a su enfermedad.
¿La diana perfecta?
Desafortunadamente, la capacidad de la telomerasa para evitar la muerte natural de las células ya había sido descubierta antes por las células cancerosas. Más del 90 por ciento de todos los tipos de tumores humanos activan a la telomerasa en algún momento de su crecimiento, consiguiendo así una capacidad para dividirse indefinidamente. Presumiblemente la selección de células con telomerasa dentro del tumor ocurre cuando los telómeros llegan a longitudes cortas y necesitan de la telomerasa para mantenerlos.
Se podría decir que las células del tumor son inmortales gracias a la telomerasa. O lo que es lo mismo, que las células tumorales dependen de la telomerasa para crecer inmortalmente. Las implicaciones terapéuticas de este descubrimiento son obvias: la telomerasa puede ser una nueva diana sobre la que actúen futuras drogas quimioterapéuticas contra el cáncer. De hecho, quizás la telomerasa sería una diana "perfecta", ya que no sólo es general a más del 90% de los cánceres humanos, si no que además no está presente en las células normales, por lo cual no cabría esperar efectos deletéreos en éstas. Hay evidencias de que esto sería así. En particular, algunos de los pacientes con el síndrome de envejecimiento prematuro, Disqueratosis congénita, son mutantes para la telomerasa, sin embargo son capaces de vivir sin telomerasa durante varios años antes de que se detecten los primeros síntomas de envejecimiento prematuro. Esto es debido a que las células normales del organismo, a diferencia de las tumorales, tienen telómeros que son suficientemente largos para sostener su crecimiento normal durante años. Así pues, durante el tiempo necesario para un tratamiento de quimioterapia (habitualmente no más de unas semanas) no cabría esperar efectos deletéreos de la inhibición de la telomerasa en los tejidos normales del organismo.
Las empresas farmacéuticas ya han desarrollado los primeros compuestos químicos que son capaces de inhibir la actividad telomerasa eficientemente y que funcionan frenando el crecimiento tumoral de las células en cultivo o en modelos animales. Es previsible que durante los próximos años se pruebe su eficacia en ensayos clínicos de cáncer humano, sólo hay que esperar.
Recientemente, se han descrito mecanismos de reparación de telómeros que son independientes de la actividad telomerasa y que se denominan ALT (Alternative Lenthening of Telomeres). La activación de ALT en tumores tratados con inhibidores de telomerasa podría resultar en la selección de clones resistentes y en la recidiva del tumor. La caracterización de los genes implicados en ALT es fundamental para poder interferir el mantenimiento de telómeros en tumores. Entre estos genes hemos encontrado miembros de la familia del retinoblastoma, las proteínas P130 y P107, que son importantes controladores de la división celular. Cuando estos genes se eliminan, los telómeros sufren un alargamiento en ausencia de cambios en la actividad telomerasa, lo cual podría facilitar el crecimiento del tumor.
¿Amiga o enemiga?
La introducción de la telomerasa en células envejecidas podría ser una manera de permitirles alargar la vida y así poder tratar síndromes de envejecimiento prematuro o patologías asociadas al envejecimiento humano. Sin embargo, esto habría que hacerlo de manera temporal y controlada ya que la telomerasa también es capaz de favorecer el crecimiento de células con alteraciones tumorales.
Una manera de predecir la importancia de un gen en enfermedades humanas es crear modelos experimentales en ratón. La manipulación genética de ratones ha permitido analizar el efecto "in vivo" de la eliminación (construcción de ratones knock out o nulos) o introducción (ratones transgénicos) de un gen de interés. Así, la importancia de la telomerasa en cáncer y en envejecimiento se ha podido demostrar usando ratones sin telomerasa. Los resultados son prometedores y han apoyado el que compañías farmacéuticas estén haciendo un esfuerzo en el desarrollo de inhibidores de telomerasa, así como el desarrollo de terapias génicas para tratamiento de enfermedades asociadas al envejecimiento.
Por una parte, se ha podido demonstrar que los ratones sin telomerasa envejecen prematuramente, y que desarrollan la mayoría de las patologías típicas del envejecimiento en humanos. Si se reintroduce telomerasa en estos ratones con telómeros cortos, estas patologías se evitan, demostrando la eficiencia de la telomerasa en "refrescar" telómeros cortos y su potencial en la terapias génicas de síndromes de envejecimiento prematuro en humanos. De manera similar se ha visto que estos ratones con telómeros cortos son resistentes a formar tumores cuando se someten a tratamientos carcinogénicos o cuando se mutan proteínas supresoras de tumores como APC, p16 o p19ARF, demostrando que drogas dirigidas contra los telómeros y la telomerasa podrían ser eficientes en el tratamiento tumoral.
Futuras aplicaciones
Si bien el interés inmediato en el campo de la telomerasa es testar la efectividad de drogas inhibidoras de la telomerasa como posible terapia antitumoral, así como paliar las enfermedades asociadas al envejecimiento mediante la reintroducción de telomerasa en células con telómeros exhaustos, las futuras aplicaciones de la telomerasa también incluyen la producción y diferenciación de tejidos in vitro a partir de células madres adultas, que también necesitan de la telomerasa para dividirse indefinidamente.
Sin embargo, independientemente de la posible aplicación de terapias basadas en la telomerasa, el estudio en profundidad de los telómeros y de la telomerasa es en sí mismo fascinante para los biólogos y sin duda nos deparará muchas sorpresas para el futuro.